7月2日,最新一期《科学进展》(Science Advances)刊发中国科学院西安光机所重要成果。超快光科学与技术全国重点实验室联合瑞士洛桑联邦理工学院,在生物光学显微成像及微操纵方面取得重要进展,提出“光镊切片显微术”,实现了悬浮生物细胞的全光式三维成像,为光镊技术开拓了新应用方向。论文第一作者为西安光机所博士研究生李星,通讯作者为西安光机所徐孝浩研究员、瑞士洛桑联邦理工学院的Olivier J. F. Martin教授和西安光机所姚保利研究员。西安光机所是第一完成单位。

光学切片(Optical Sectioning, OS)能够有效分离光学成像过程中的离焦信号而提取焦信号,是解析细胞三维结构和厚组织深层形态的重要工具,其实现方法包括共聚焦、双光子、光片、结构光照明显微等技术。然而,这些技术依赖对样品的机械式固定或粘附,难以适用于悬浮运动目标,限制了其在细胞原位观测中的应用。此外,人工固定方法存在干扰细胞正常生理机能的风险。
为解决悬浮细胞三维成像难题,该研究将团队的两大特色研究方向全息光镊(HOT)与结构光照明显微(SIM)进行结合,研制出光镊切片显微术(OTSM),为光学切片三维成像提供了全光式解决方案。该技术的基本思想是利用全息光镊对悬浮细胞进行固定和轴向扫描,在每个轴向切片位置,采集三幅等相移的结构光照明图像,最后通过OS-SIM算法重建细胞的三维图像(见图1、图2)。
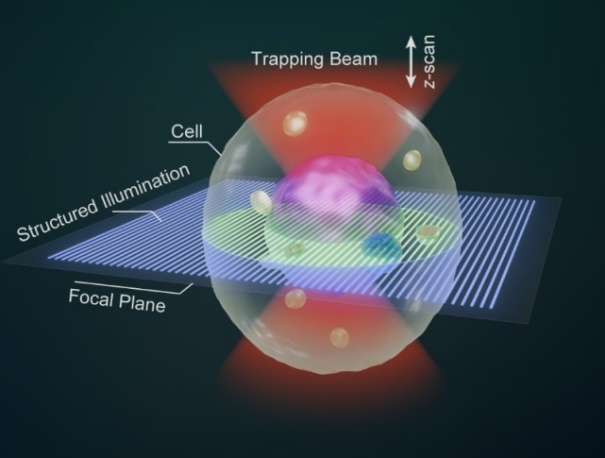
图1、光镊切片显微术的基本原理
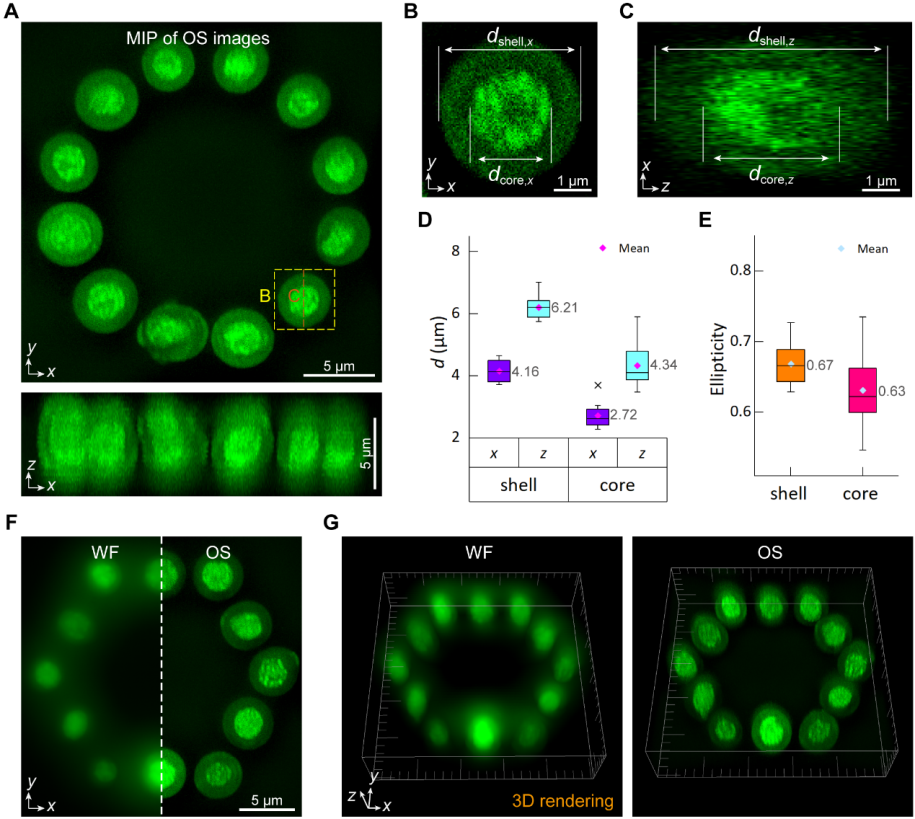
图2. 光镊切片显微术对12个悬浮酵母菌细胞排布形成几何图案的3D成像
其中全息光镊在该技术中扮演了三重重要角色:
首先,它通过瓣状光势阱实现细胞的多自由度光学束缚,将其布朗运动限制在成像分辨率和结构光条纹周期以内,这对于结构光照明显微成像至关重要。
其次,全息光镊对细胞的轴向操控能力满足样品扫描需求,消除了对机械平移台的依赖。
最后,集成全息光镊的显微技术展现出多功能性,兼具对细胞阵列的三维组装和成像功能,有望为细胞动力学及胞间通信研究提供三维视角。
该工作率先实现了光学微操纵技术与结构光照明显微的交叉融合,通过光镊的非接触式操控能力,突破了悬浮细胞光学切片三维成像的技术瓶颈,建立了“光学捕获-光学切片-三维重构”的技术途径,为生物成像与操控从2D向3D范式转换提供了一条重要途径。该研究成果还将促进光镊与其它显微技术的跨领域融合研究,以满足一些应用中对各向同性分辨率、大视场和超分辨率成像的需求。
该研究工作得到国家自然科学基金委员会国家重大科研仪器研制项目、重点项目、国家重点研发计划等项目的支持。
姚保利团队在基于光场调控的光学显微成像和光学微操纵方面开展了长期的理论和实验研究工作,在PNAS、Nature Com.、PRL、Rep. Prog. Phys.、Adv. Opt. Photon.等期刊发表论文300余篇,授权多项国家发明专利,曾获陕西省科学技术一等奖、二等奖和陕西省重点科技创新团队等奖励和荣誉。
(瞬态室供稿)



